性質および化学反応
単体は二原子分子であり、無色無臭の比較的不活性の気体であるが、数百℃、数百気圧の高圧化で水素と結合しアンモニアを形成する。室温でリチウムと反応し、高温では窒素ガス中でマグネシウムは燃焼し、それぞれ窒化物を生成する。単体窒素は亜硝酸ナトリウムおよび塩化アンモニウムの混合水溶液を加熱することにより得られる。またアジ化ナトリウムまたはアジ化バリウムを加熱分解することにより高純度の窒素が得られる。
酸素を除いた空気の大部分は窒素から成り、窒息する空気であるため窒素と命名された。英語名はラテン語で硝石を意味するNitronに由来する。
一酸化窒素生成反応は吸熱的で、常温では酸素と直接反応しないが、高温では反応し、自動車のエンジン内で窒素酸化物が発生する原因となっている。
| 水素との反応 |
N2 + 3H2 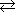 2NH3 2NH3 |
| リチウムとの反応 |
6Li + N2 → 2Li3N |
| マグネシウムとの反応 |
3Mg + N2 → Mg3N2 |
| 亜硝酸アンモニウム水溶液の加熱 |
NH4+ + NO2- → N2 + 2H2O |
ΔH °= -48.7kJ/mol |
| アジ化ナトリウムの加熱 |
2NaN3 → 2Na + 3N2 |
ΔH °= -43.42kJ/mol |
| 高温での酸素との反応 |
N2 + O2 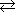 2NO 2NO |
ΔH °= +180.5kJ/mol |
 窒素ボンベ
窒素ボンベ
自然界における存在
大気の78.08vol%は単体の窒素である。窒素を含む鉱物としては硝酸塩が主なもので硝石KNO3およびチリ硝石NaNO3があるが雨の多い日本国内では産出せず、南米チリのような乾燥地帯で産出する。
 大気の大部分を占める窒素
大気の大部分を占める窒素
工業的用途
不活性ガスとして食品の保存用、液体窒素は冷却用に用いられる。
硝酸カリウムは硝石または煙硝とも呼ばれ、黒色火薬に用いられる。戦国時代の鉄砲伝来以降、黒色火薬の需要が増大したが、わが国では硝石は産出しないため、煙硝はタバコがら、そばがらおよび蚕糞などを硝酸菌発酵させた後、灰を加えて濾過し再結晶して製造されていた。重要戦略物資であったため、秘境であった飛騨白川郷および越中五箇山のような山奥で秘かに製造されていた。硝酸の「硝」は火薬の材料である煙硝(硝石)に由来する。
ドイツではハーバーが空気と水を原料に取り出した窒素と水素の混合物を、四三酸化鉄を触媒として約500℃、200〜1000気圧の高圧下でアンモニアを合成する工業的製法を確立した。
さらにオストワルドはアンモニアを白金触媒により酸化させ、水と反応させることにより硝酸を工業的に製造することに成功した。この発明によりドイツは第一次世界大戦中、火薬の原料である硝石の輸入ルートを絶たれていたが、国内で空気中の窒素を固定することにより火薬の原料を合成していた。
| ハーバー・ボッシュ法によるアンモニアの合成 |
N2 + 3H2 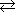 2NH3 (Fe3O4触媒) 2NH3 (Fe3O4触媒) |
ΔH °= -92.22kJ |
| オストワルド法による硝酸の合成 |
| 4NH3 + 5O2 → 4NO + 6H2O (Pt触媒) |
| 2NO + O2 → 2NO2 |
| 3NO2 + H2O → 2HNO3 + NO |
 |  |
| 越中五箇山合掌造り | 煙硝(硝酸カリウム)KNO3 |
主な化合物
化合物中の窒素の酸化数には-3, -2, -1, +1, +2, +3, +4, +5などが存在する。
| NH3 |
アンモニア |
Ammonia |
| HN3 |
アジ化水素 |
Hydrogen Azide (Hydrazoic Acid) |
| N2O |
一酸化二窒素(笑気) |
Dinitrogen Monoxide (Nitrous Oxide) |
| NO |
一酸化窒素 |
Nitrogen Monoxide (Nitric Oxide) |
| N2O3 |
三酸化二窒素 |
Dinitrogen Trioxide |
| NO2 |
二酸化窒素 |
Nitrogen Dioxide |
| N2O5 |
五酸化二窒素 |
Dinitrogen Pentoxide |
| HNO2 |
亜硝酸 |
Nitrous Acid |
| HNO3 |
硝酸 |
Nitric Acid |
|



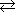 2NH3
2NH3
