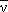性質および化学反応
銀灰色の金属元素であり、空気中では表面が酸化されて灰褐色を呈する。塩酸および希硫酸には極めてゆっくりと溶解し、水素および赤色の2価のアクアコバルトイオン[Co(H2O)6]2+を生成する。
塩化コバルト(Ⅱ)六水和物はアクア錯イオンを含み赤色であるが、加熱脱水し無水物になると四面体型4配位となり濃い青色になる。これは可逆的に吸湿して赤色になる。
通常は2価の状態が安定であるが、塩化コバルト(Ⅱ)水溶液にアンモニアなど、窒素原子を有する塩基を加えて空気酸化を行うと、安定な3価の状態の錯体を生成する。3価コバルト錯体は低スピン状態で反磁性の性質をもち、八面体型六配位構造であり、多くの種類のものが合成されている。3価のアクアコバルトイオン[Co(H2O)6]3+は硫酸酸性溶液中で2価陽イオンを電解酸化させることにより得られる、藍色の反磁性のイオンであるが、不安定で水溶液中で酸素を発生しながら分解し、2価に戻る。ヘキサフルオロコバルト(Ⅲ)酸イオン[CoF6]3-は、数少ない3価コバルトの高スピン状態をとる錯体であり常磁性を示す。
金属コバルトは鉄と同様に強磁性を示し飽和磁気モーメントσsは20℃で161 [4π×10-4Wb·m]であり、磁石に吸い付けられ、キュリー点は1131℃で金属単体中では最高である。
| 塩酸との反応 |
Co + 2HCl → CoCl2 + H2 |
| 空気酸化によるアンミン錯体の合成 |
4CoCl2 + 16NH3 + 4NH4Cl + O2 → 4[CoCl(NH3)5]Cl2 + 2H2O |
| 3価アクアイオンの分解 |
4[Co(H2O)6]3+ + 2H2O → 4[Co(H2O)6]2+ + O2 + 4H+ |
 コバルトの単体
コバルトの単体
自然界における存在
隕鉄中には0.3%程度のコバルトが含まれ、地球中心部の核にもこの程度の比率で含まれているものと考えられる。コバルトは通常ニッケルと共存することが多いが、輝コバルト鉱CoAsSのような独自の鉱物を形成することもある。これが酸化されると二次的な鉱物として、美しい赤紫色を呈するコバルト華Co3(AsO4)2·8H2Oを生成する。
カロール鉱Cu(Co,Ni)2S4のようなニッケルおよびコバルトを中心に含有する鉱物も存在する。
ビタミンB12はコバラミンと呼ばれ、分子の中心部にコバルト原子を含む。
 |  |
| コバルト華 モロッコ産 | カロール鉱 コンゴ共和国産 |
工業的用途
コバルトとサマリウムの合金は超強力磁石の材料として用いられる。アルミン酸コバルトCoAl2O4はスピネル型結晶格子でコバルトブルーと呼ばれ、陶磁器およびガラスの着色に用いられる。酸化コバルト(Ⅲ)リチウムLiCoO2はリチウム二次電池の優れた正極活物質である。
放射性同位体である60Coは癌治療用、植物の品種改良およびジャガイモの発芽防止のための照射用に放射線源として用いられる。
| 60Co原子核のβ-壊変 |
60Co → 60Ni + e- +  |
Q = +2823.07keV |
主な化合物
単純なイオン性化合物中ではコバルト原子は2価のアクアイオン[Co(H2O)6]2+として存在することが多いが、窒素を含む塩基などが配位結合した場合は3価状態のものが数多く存在する。
| CoCl2·6H2O |
塩化コバルト(Ⅱ)六水和物 |
Cobalt(Ⅱ) Chloride Hexahydrate |
| CoSO4·7H2O |
硫酸コバルト(Ⅱ)七水和物 |
Cobalt(Ⅱ) Sulfate Heptahydrate |
| [Co(NH3)6]Cl3 |
ヘキサアンミンコバルト(Ⅲ)塩化物 |
Hexaamminecobalt(Ⅲ) Chloride |
| [CoCl(NH3)5]Cl2 |
クロロペンタアンミンコバルト(Ⅲ)塩化物 |
Chloropentaamminecobalt(Ⅲ) Chloride |
| K3[Co(CO3)3] |
トリカルボナトコバルト(Ⅲ)酸カリウム |
Potassium Tricarbonatocobaltate(Ⅲ) |
 塩化コバルト(Ⅱ)六水和物
塩化コバルト(Ⅱ)六水和物
|