 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
گ«ژ؟‚¨‚و‚ر‰»ٹw”½‰پ@‰–ژ_‚¨‚و‚رٹَ—°ژ_‚ئڈ™پX‚ة”½‰‚µ‚ؤ—n‰ً‚µ’W—خگF‚ج‚Q‰؟‚جƒAƒNƒA“SƒCƒIƒ“[Fe(H2O)6]2+‚ًگ¶گ¬‚·‚é‚ھپA‚±‚ê‚ح‚â‚ھ‚ؤ‹َ‹Cژ_‰»‚³‚ê‚R‰؟‚ة•د‰»‚·‚éپBٹَڈةژ_’†‚إ‚حƒjƒgƒچƒVƒ‹چِ‘ج[Fe(NO)(H2O)5]2+‚ًگ¶‚¶‚ؤچ•ٹŒگF—n‰t‚ئ‚ب‚èپAژں‘و‚ة‚R‰؟ƒCƒIƒ“‚ئ‚ب‚éپB”Zڈةژ_’†‚إ‚حژ_‰»”ç–Œ‚ًگ¶‚¶‚ؤ•s“®‘ش‚ئ‚ب‚èپA”½‰‚ھ’âژ~‚·‚éپB‚R‰؟‚جƒAƒNƒAƒCƒIƒ“[Fe(H2O)6]3+‚ح–{—ˆ’Wژ‡گF‚إ‚ ‚é‚ھپA’تڈي‚حگ…—n‰t’†‚إ‰ءگ…•ھ‰ً‚µƒqƒhƒچƒLƒ\چِ‘ج[Fe(OH)(H2O)5]2+‚ب‚ا‚ًŒ`گ¬‚µ‚ؤ‰©گF‚ً’و‚·‚éپB‚¤‚·‚¢ƒAƒ‹ƒJƒٹ‚ئ‚ح‚ظ‚ئ‚ٌ‚ا”½‰‚µ‚ب‚¢‚ھپA•¦“«‚µ‚½”Zگ…ژ_‰»ƒiƒgƒٹƒEƒ€گ…—n‰t‚ئ‚حڈ™پX‚ة”½‰‚µƒeƒgƒ‰ƒqƒhƒچƒLƒ\“S(Ⅱ)ژ_ƒCƒIƒ“‚ًگ¶گ¬‚·‚éپB پ@’تڈيپu“Sپv‚ئڈج‚µ‚ؤ‚¢‚é‚à‚ج‚حچ|“S‚إ‚ ‚èپA0.1پ`2پ“’ِ“x‚ج’Y‘f‚¨‚و‚ر”÷—ت‚جƒ}ƒ“ƒKƒ“‚ب‚ا‚ًٹـ‚قپBڈƒ“S‚ح“d‹C•ھ‰ً‚ـ‚½‚ح“SƒJƒ‹ƒ{ƒjƒ‹[Fe(CO)5]‚ج”M•ھ‰ً‚ب‚ا‚إگ»‘¢‚³‚êپAڈƒ“x‚جچ‚‚¢‚à‚ج‚ظ‚ا“î‚ç‚©‚پA‚³‚ر‚ة‚‚‚ب‚éپB“S‚ح’ک‚µ‚¢‹ژ¥گ«‚ًژ¦‚µ–Oکaژ¥‹Cƒ‚پ[ƒپƒ“ƒgσs‚ح20پژ‚إ218.0 [4π×10-4Wb·m]پA770پژ‚جƒLƒ…ƒٹپ[“_ˆبڈم‚إ‚حڈيژ¥گ«‚ئ‚ب‚éپB پ@“S‚ح‰½’iٹK‚©‚ج‘ٹ“]ˆع‚ً‹N‚±‚µپAژ؛‰·‚إ‚ح‘جگS—§•ûٹiژq‚جα“S‚إ‚ ‚é‚ھپAƒLƒ…ƒٹپ[“_ˆبڈم‚حβ“SپA910پژ‚إŒ‹ڈ»ٹiژq‚ھ•د‰»‚µ‚ؤ–تگS—§•ûٹiژq‚ئ‚ب‚ء‚½‚à‚ج‚حγ“SپA‚³‚ç‚ة1400پژˆبڈم‚إ‚ح‘جگS—§•ûٹiژq‚جδ“S‚ة•د‰»‚·‚éپB
 ژ©‘RٹE‚ة‚¨‚¯‚鑶چفپ@‰خگ¬ٹâ’†‚إ‚ح“S‚حژه‚ة‹Pگخ(Mg,Fe)2Si2O6پAƒJƒ“ƒ‰ƒ“گخ(Mg,Fe)2SiO4‚¨‚و‚رژ¥“SچzFe3O4‚ب‚ا‚ج—LگFچz•¨‚ئ‚µ‚ؤ•پ•ص“I‚ة‘¶چف‚·‚éپBژ¥“Sچz‚ًٹـ‚قٹâگخ‚ھ•—‰»‚µپA‘حگد‚µ‚½‚à‚ج‚ھچ»“S‚إ‚ ‚éپB“Sچzگخ‚ة‚حژ¥“Sچz‚¨‚و‚رگش“SچzFe2O3‚ب‚ا‚ھ‚ ‚èپA‚»‚ꂼ‚êچ•ژK‚¨‚و‚رگشژK‚جگ¬•ھ‚إ‚à‚ ‚éپBژ¥“Sچz‚ح‹tƒXƒsƒlƒ‹Œ^چ\‘¢‚ً‚ئ‚èپA‚±‚ê‚حژ_‰»•¨ƒCƒIƒ“‚ھ–تگS—§•ûٹiژq‚ً‚ب‚µپA‚±‚جگ³ژl–ت‘جŒ^‚S”zˆتƒTƒCƒg‚ج1/8‚ًFe3+‚ھگè‚كپAگ³”ھ–ت‘جŒ^‚U”zˆتƒTƒCƒg‚ج‚»‚ꂼ‚ê1/4‚ًFe2+‚ئFe3+‚ھگè‚ك‚ؤ‚¢‚éچ\‘¢‚إ‚ ‚è‹ژ¥گ«‚ًژ¦‚·پB پ@“S•ھ‚ًٹـ‚قٹâگخ‚ھ•—‰»‚µپAگ…ژ_‰»“S(Ⅲ)‚ھ’¾’…‚µ‚ؤگ¶گ¬‚µ‚½‚à‚ج‚ھٹŒ“Sچz‚إ‚ ‚éپBگA•¨‚جچھ‚ة“›ڈَ‚ةگ¶گ¬‚µ‚½‚à‚ج‚حچ‚ژtڈ¬‘m‚ئŒؤ‚خ‚êپA’c‰ٍڈم‚ة’¾’…‚µ‚½Œمٹ£‘‡‚·‚邱‚ئ‚ة‚و‚è“à•”‚ة‹َٹش‚ھگ¶‚¶‚½‚à‚ج‚ح–آگخ‚ئŒؤ‚خ‚ê‚éپB‚ـ‚½‰©“Sچz‚ھ•—‰»•دژ؟‚µپAŒـٹpڈ\“ٌ–ت‘ج‚ ‚é‚¢‚ح—§•û‘ج‚جŒ‹ڈ»Œ`‚ً•غژ‚µ‚½‚à‚ج‚ح‚»‚ꂼ‚ê•گگخ‚¨‚و‚رeگخ‚ئŒؤ‚خ‚ê‚éپB پ@گشŒŒ‹…‚جگF‘f‚إ‚ ‚èپA‘ج“à‚ةژ_‘f‚ً‰^”ہ‚·‚é‚ح‚½‚ç‚«‚ج‚ ‚éƒwƒ‚ƒOƒچƒrƒ“‚ح•ھژq—ت‚ھ‚W–œ’ِ“x‚ج‚½‚ٌ‚د‚ژ؟‚إپA‚S‚آ‚جƒTƒuƒ†ƒjƒbƒg‚ئŒؤ‚خ‚ê‚é’Pˆت‚©‚ç‚ب‚èپA‚»‚ꂼ‚ê‚ج’†گS•”‚ةƒwƒ€‚ئŒؤ‚خ‚ê‚éƒ|ƒ‹ƒtƒBƒٹƒ“ٹآ‚ةˆح‚ـ‚ꂽ“SŒ´ژq‚ھ‘¶چف‚µپA‚±‚ê‚ھژ_‘f•ھژq‚ً‚ن‚é‚Œ‹چ‡‚³‚¹‚éƒTƒCƒg‚إ‚ ‚éپB
چH‹ئ“I—p“rپ@“ْ–{Œأ—ˆ‚ج‚½‚½‚çگ»“S‚إ‚حŒ´—؟‚ئ‚µ‚ؤچ»“S‚¨‚و‚ر–ط’Y‚ً—p‚¢پA“V”‰‚س‚¢‚²‚ة‚و‚è‹َ‹C‚ً‘—‚è‚ب‚ھ‚ç‚QڈTٹش’ِ“x”R‚₵‘±‚¯پA‹تچ|‚ً“¾‚ؤ‚¢‚½پBژèچH‹ئ‚إڈ¬‹K–ح‚إ‚ ‚é‚ھ—اژ؟‚ج“S‚ھچى‚ç‚ê‚ؤ‚¢‚½پB
ژه‚ب‰»چ‡•¨
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
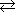 [Fe(OH)(H2O)5]2+ + H+
[Fe(OH)(H2O)5]2+ + H+






