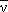性質および化学反応
淡い黄金色を帯びた極めて軟らかい金属元素である。最も陽性の強い元素で電気陰性度および第一イオン化エネルギーは最小であり、1価の安定な陽イオンCs+を形成する。そのイオン半径1.84Åは金属陽イオンとしては最も大きいため、水酸化セシウムは水酸化物中で最も強い塩基性を示す。過塩素酸塩CsClO4および明礬CsAl(SO4)2·12H2Oは水に難溶であり、ヘキサクロロ白金酸塩Cs2[PtCl6]はカリウム塩よりもさらに難溶性である。
化学的性質はカリウムおよびルビジウムに類似するが、単体はさらに反応性に富み、空気に触れると激しく発火し、水と接触すると爆発的に反応する。液体アンモニアに容易く溶解し、濃青色溶液を生ずる。金属元素としては水銀に次いで融点が低く、夏季には液体になることがある。淡青紫色の炎色反応を示し、元素名はこのスペクトルの空色を意味するラテン語のCaesinoに由来する。英語ではCaesium(英)とCesium(米)の二通りの綴りが存在する。
セシウムのような反応性の高い金属は融解電解により製造することが作業上困難となるため、真空中でガラス管に封入した塩化セシウムをマグネシウムにより加熱還元するか、クロム酸セシウムをケイ素で加熱還元することにより得られ、いずれも蒸留してくる金属を冷却して捕集する。
放射性同位体である135Csおよび137Csはウランの核分裂生成物中に含まれ、特に放射線エネルギーの強い137Csは体内ではカリウムイオンと伴に挙動し、長時間放射線を出し続ける。
| クロム酸セシウムの還元 |
4Cs2CrO4 + 5Si → 8Cs + 2Cr2O3 + 5SiO2 |
ΔH °= -1117.6kJ |
| 137Csのβ-壊変 |
137Cs → 137mBa + e- +  |
Q = +513.98keV |
 セシウムの単体
セシウムの単体
自然界における存在
セシウムはイオン半径が大きいため、長石中のカリウムイオンサイトに取り込まれることは少ない。また存在度が低いため、マグマ凝固時に最後まで取り残され、ポリューサイト(Cs1-xNax)AlSi2O6·xH2Oのような独自の鉱物を形成することが多い。またリシア雲母のカリウムの一部を置換していることもある。
 ポリューサイト パキスタン産
ポリューサイト パキスタン産
工業的用途
金属セシウムは仕事関数が1.95 eVで単体中で最小であり、真空中で電子を放出しやすいため、光電管に使用される。セシウム原子時計は時間の基準に用いられ、133Cs原子の基底状態の2つの超微細準位(F=4,M=0およびF=3,M=0)間の遷移に対応する放射の9,192,631,770周期の継続時間を1秒と定義する。セシウム化合物はメタクリル樹脂の重合触媒に用いられる。
主な化合物
化合物中ではセシウムは常に1価の陽イオンCs+として存在する。
| CsOH |
水酸化セシウム |
Cesium Hydroxide |
| Cs2CO3 |
炭酸セシウム |
Cesium Carbonate |
| CsCl |
塩化セシウム |
Cesium Chloride |
| Cs2SO4 |
硫酸セシウム |
Cesium Sulfate |
| CsNO3 |
硝酸セシウム |
Cesium Nitrate |
|