性質および化学反応
青みを帯びた銀白色の極めて硬い金属で、表面に薄い酸化皮膜を形成しやすいため錆は内部まで進行しにくい。薄い酸にゆっくりと溶解するが、硝酸に対しては不動態を形成し反応しにくい。高純度のクロムを希塩酸および希硫酸に溶解すると最初に青色の2価のクロムイオンCr2+を生成するが、酸化されやすく3価Cr3+になりやすい。
3価のクロムは3価コバルトと同様、八面体型六配位の比較的安定な錯体を形成するが、d3電子配置であり、t2g軌道が半数満たされ、常磁性を示し、コバルト錯体よりも置換活性である。
鮮やかな黄色を呈するクロム酸イオンCrO42-、および橙色の二クロム酸イオンCr2O72-は六価クロムと呼ばれ、硫酸酸性中で強い酸化作用を示し毒性がある。クロム酸イオンは酸性溶液中では縮合して二クロム酸イオンになるが、この反応は可逆的で塩基性ではクロム酸イオンになる。
| 薄い酸との反応 |
Cr + 2H+ → Cr2+ + H2 |
| 2価イオンの酸化 |
2Cr2+ + 2H+ → 2Cr3+ + H2 |
| 硫酸酸性中での二クロム酸イオンの酸化作用 |
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O |
E °= +1.29 V |
| クロム酸イオンの平衡 |
2CrO42- + 2H+ 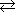 Cr2O72- + H2O Cr2O72- + H2O |
K = 3.1×1014 |
 クロムの単体
クロムの単体
自然界における存在
クロムは火成岩中に普遍的に存在し、塩基性岩、特に橄欖岩中にスピネル構造をもつクロム鉄鉱FeCr2O4の形で含まれ、これは重要なクロムの鉱石である。また柘榴石および雲母などのアルミニウムの一部または大部分を置換し、美しい緑色を呈する、灰クロム柘榴石Ca3Cr2(SiO4)3およびクロム雲母K(Al,Cr)2AlSi3O10(OH)2などがクロム鉄鉱に伴って産出する。
 |  |
| 橄欖岩中のクロム鉄鉱 東赤石山産 | クロム雲母 四国中央市五良津山産 |
工業的用途
自動車のバンパー、自転車のフレームおよび水道の蛇口など、あらゆる鋼鉄製部品は錆を防ぐためにクロムめっきされている。クロムめっきでは有毒な六価クロムである三酸化クロムを用いるため、工場での廃液処理が不充分であると汚染を引き起こす場合がある。ステンレスはクロムが表面に酸化皮膜を形成し錆の進行を防ぐことを利用した合金であり、18-8 Stainless Steelはクロムを18%、ニッケルを8%含有する鋼鉄を指す。
主な化合物
化合物中ではクロム原子の酸化数は+2,+3,+6をとることが多い。
| Cr2O3 |
酸化クロム(Ⅲ) |
Chromium(Ⅲ) Oxide |
| KCr(SO4)2·12H2O |
硫酸カリウムクロム(Ⅲ)十二水和物(クロム明礬) |
Potassium Chromium(Ⅲ) Sulfate Dodecahydrate |
| CrO3 |
酸化クロム(Ⅵ) |
Chromium(Ⅵ) Oxide |
| K2CrO4 |
クロム酸カリウム |
Potassium Chromate |
| K2Cr2O7 |
二クロム酸カリウム |
Potassium Dichromate |
 |  |
| 硫酸カリウムクロム(Ⅲ)十二水和物 | クロム酸カリウム |
|


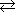 Cr2O72- + H2O
Cr2O72- + H2O


