 | |||||||||||||||||||||||||||||||
性質および化学反応水素分子には二個の水素原子核の合成スピンがS=1のオルト水素とS=0のパラ水素が存在し、極低温では平衡状態においてエネルギー的に1410 J/molだけ低いパラ水素が大部分を占めるが、室温付近より高温ではオルト水素が約75%を占めるようになる。またオルト水素とパラ水素の相互変換速度は極めて遅く、平衡に達するまで数千時間以上を要する。 化学的性質として水素はフッ素とは常温で激しく反応し、酸素および塩素との混合物は点火により爆発的に反応する。ヨウ素および窒素との混合物は生成物との平衡状態になる。高温でリチウムおよびカルシウムなどと直接反応して水素化物を生成する。これらはヘリウムの電子配置に等しい水素化物イオンH-を含み、水素化リチウムを融解電解すると陽極で水素化物イオンが酸化され水素ガスが発生する。 水素は他の非金属元素と異なり、安定な陽イオンである水素イオンH+を生成しやすいが、これはプロトン(陽子)と呼ばれ、イオン半径が極めて小さく原子核の半径に相当し、通常は非共有電子対を持つ分子に捕捉され、水溶液中ではオキソニウムイオンH30+として存在する。Brφnstedの酸・塩基反応はプロトンの移動反応である。
自然界における存在大気圏上部の熱圏では水分子が解離することにより生成した水素は、分子量が小さいため高い分子運動速度ををもち、一部が地球の脱出速度を超えるため、宇宙に散逸する。その一方で流星として地球に降り注ぎ、もたらされる物質は石質隕石および隕鉄よりも氷隕石が圧倒的に多いと推定される。 恒星の大気中に最も多く存在する元素で、太陽では91atom%を占めプラズマ状態で存在し、核融合のエネルギー源となっている。木星型惑星では大気の主成分を成し、惑星内深部では100 GPa以上の圧力下で金属水素を生じていると推定されている。
工業的用途主に不飽和脂肪酸から構成される魚油および植物油に、ニッケルを触媒として水素を添加すると飽和脂肪酸の比率が高くなり、融点が高くなるため硬化油と呼ばれ、マーガリンなどに利用される。またハーバー法によるアンモニア合成、および塩化水素などの合成原料として用いられる。石油の脱硫および脱硝は水素ガスを反応させて、硫化水素およびアンモニアとして脱離させることにより行われる。 水素の燃焼による発熱量は高く、排気ガスも水蒸気しか出さないため燃料としての開発が行われている。水素と酸素を電極上で反応させることにより起電力を発生させる燃料電池は、効率の高い動力源として開発が進行中であるが電極材料などのコストが課題であり、さらに水素は現在では石油の分解およびコークスと水蒸気との反応により製造されており、結局二酸化炭素の排出につながることなどの問題を抱えている。 主な化合物
|
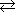 2HI(g)
2HI(g)


