性質および化学反応
金属単体を初めて単離したのはイギリスのH.Davyであり、塩化カルシウムの融解電解によって得たのは1808年のことである。DavyはこのほかにもNa,Mg,K,SrおよびBaを塩化物または水酸化物の融解電解、または水溶液を水銀を陰極として電解し、生成したアマルガムの水銀を蒸発させることにより単体を得ている。
銀白色の金属元素であるが空気中で酸化されやすく酸化カルシウムとなり、やがて炭酸塩なども生じ、錆びた鉛のような外観となる。水とは最初は徐々に次第に激しく反応して水素ガスを発生し水酸化カルシウムを生ずる。液体アンモニアには少量溶解し、青色の溶液を生ずる。暗橙赤色の炎色反応を示す。イオンCa2+は電荷のためにアルカリ金属イオンより強く水和し、化合物も結晶水を持つものが多くなり、塩化物CaCl2および硝酸塩Ca(NO3)2などは吸湿性を示す。炭酸塩CaCO3および硫酸塩CaSO4など2価の陰イオンとの間で形成される塩類は水に難溶性のものが多い。
カルシウムなどの2族元素は、アルカリ金属とアルミニウムなどの土類および希土類との中間に位置することからアルカリ土類金属Alkali Earthと呼ばれ、水酸化物Ca(OH)2は強い塩基性を示すが、アルカリ金属と比較すると水に対する溶解度が小さく(Ksp = 5.5×10-6)塩基性も弱くなる。水酸化カルシウムの飽和溶液は石灰水と呼ばれpH = 12.4のアルカリ性を示し、二酸化炭素により炭酸カルシウムを生じて白濁し、さらに過剰に吹き込むと炭酸水素カルシウムを生成して透明な溶液となる。この反応は可逆的で石灰岩が地下水により浸食されて鍾乳洞が形成され、鍾乳石および石筍などができる原因である。
| 大気中での酸化 |
2Ca + O2 → 2CaO |
ΔH °= -1270.18kJ |
| 水との反応 |
Ca + 2H2O → Ca(OH)2 + H2 |
ΔH °= -431.16kJ |
| 石灰水と二酸化炭素との反応 |
Ca(OH)2aq + CO2(g) → CaCO3(s)↓ + H2O |
Ksp = 5.0×10-9 |
| 炭酸カルシウムと過剰の二酸化炭素との反応 |
CaCO3(s) + CO2(g) + H2O 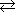 Ca(HCO3)2aq Ca(HCO3)2aq |
K = 4.6×10-5 |
| カルシウムイオンと硫酸イオンとの反応 |
Ca2+aq + SO42-aq + 2H2O → CaSO4·2H2O(s)↓ |
Ksp = 4.3×10-5 |
 カルシウムの単体
カルシウムの単体
自然界における存在
火成岩中では灰長石CaAl2Si2O8および斜長石中NaXCa1-xAl2-xSi2+xO8に普遍的に存在する。カルシウムの資源として最も重要なものは石灰岩CaCO3であり、これはかつて地球を覆っていた多量の二酸化炭素が炭酸イオンの形で海水中に溶存しているカルシウムイオンと伴に、珊瑚を介して、また飽和溶液から析出して生成したものである。
炭酸カルシウムからなる最も普通の鉱物は方解石で、モースの硬度計では3度と定義され、また複屈折により透過光が二重に見える六方晶系の結晶であり、マグネシウムおよびマンガンなど比較的イオン半径の小さな2価イオンの炭酸塩鉱物に多く見られる結晶系である。方解石と同質異像の鉱物には霰石があり、これは斜方晶系であり、バリウム、ストロンチウムおよび鉛などイオン半径の大きな2価イオンを含む炭酸塩に見られる結晶系である。石膏CaSO4·2H2Oは海水から結晶したものでモースの硬度計で2度と定義される。
 |  |
| 方解石 | 霰石 モロッコ産 |
 透石膏 メキシコ産
透石膏 メキシコ産
 |  |
| 竜宮城鍾乳洞 石垣島 | 四国カルスト |
工業的用途
金属カルシウムは塩化カルシウムの融解電解または真空中で酸化カルシウムをアルミニウムにより還元し、蒸留してくる金属を捕集することによっても得られるが、需要は少量であり、酸素との結合力が強いことを利用して、真空用ゲッターおよび合金中の脱酸剤などに使用される。また還元剤として希土類元素などの金属を製造するために用いられる。
化合物としての使用が圧倒的に多く、石灰石はセメントの原料として用いられ、生石灰は乾燥剤、消石灰は漆喰、肥料およびグランドのライン引きなどに用いられる。無水塩化カルシウムは乾燥剤、塩化カルシウム二水和物は凝固点降下を利用して融雪剤に用いられる。
| 石灰石から生石灰の製造(>900℃) |
CaCO3(s) → CaO(s) + CO2(g) |
ΔH °= +178.32kJ |
| 生石灰の消和反応 |
CaO(s) + H2O(l) → Ca(OH)2(s) |
ΔH °= -65.17kJ |
| 生石灰のアルミニウムによる還元 |
4CaO + 2Al → 3Ca + CaAl2O4 |
ΔH °= +214.1kJ |
主な化合物
化合物中ではカルシウムは常に2価の陽イオンCa2+として存在する。
| CaO |
酸化カルシウム(生石灰) |
Calcium Oxide |
| Ca(OH)2 |
水酸化カルシウム(消石灰) |
Calcium Hydroxide |
| CaCO3 |
炭酸カルシウム |
Calcium Carbonate |
| CaC2 |
カルシウムアセチリド(カーバイド) |
Calcium Acetylide |
| CaCl2·6H2O |
塩化カルシウム六水和物 |
Calcium Chloride Hexahydrate |
| CaS |
硫化カルシウム |
Calcium Sulfide |
| CaSO4·2H2O |
硫酸カルシウム二水和物(石膏) |
Calcium Sulfate Dihydrate |
| Ca(NO3)2·4H2O |
硝酸カルシウム四水和物 |
Calcium Nitrate Tetrahydrate |
|



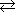 Ca(HCO3)2aq
Ca(HCO3)2aq


