性質および化学反応
カルキ臭を持つ有毒な淡黄色の気体元素で常温常圧では二原子分子として存在し、水に溶解すると不均化を起こし酸性および酸化作用を示す。アルカリ金属およびアルカリ金属は塩素ガスと接触するだけで発火し反応するが、アンチモン粉末でも発火し、塩化物を生成する。塩素水は金および白金とも反応する。電子親和力が最も高い元素であり、安定な1価の陰イオンCl-を形成しやすい。17族元素は塩をつくる元素という意味でハロゲンHalogenと呼ばれる。
塩素ガスは濃塩酸に二酸化マンガン、過マンガン酸カリウム、晒粉または過酸化水素などの酸化剤を加えることにより発生させ、濃硫酸を通して乾燥させることにより得られる。
また漂白剤として使用されている次亜塩素酸ナトリウムに、酸性洗剤の成分である塩酸を混合すると反応して塩素が発生する。この毒ガスの発生する反応は一般家庭で使用されている薬剤同士で起こり得るため、その危険性を十分認識しなければならない。洗剤メーカーでは事故が起こって以来「混ぜるな危険!」の表示を行うようになった。
| 水中での不均化 |
Cl2 + H2O 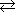 H+ + Cl- + HClO H+ + Cl- + HClO |
K = 6.2×10-2 |
| 濃塩酸と二酸化マンガンとの反応 |
4HCl + MnO2 → MnCl2 + Cl2 |
| 漂白剤と酸性洗剤との反応 |
NaClO + 2HCl → NaCl + H2O + Cl2 |
 塩素の単体
塩素の単体
自然界における存在
塩化物イオンは海水中に溶存している最も多い化学種である。岩石中では方ソーダ鉱(ソーダライト)Na8Al6Si6O24Cl2、角銀鉱AgClおよび塩素燐灰石Ca5Cl(PO4)3などが存在するが産出は多くない。海水が干上がることにより生成した岩塩は大陸では産出が多いが、雨量の多いわが国では産出しない。
 |  |
| 塩素燐灰石 ブラジル産 | 岩塩 内モンゴル自治区産 |
工業的用途
単体塩素は浄水場での水の処理時に有機物を分解するため、および水道水の殺菌のために添加される。しかし、有機物の汚染のひどい水を原水として使用する場合は、発がん性のトリハロメタンを生成するため問題になっている。またクロール法による金属チタン製造時に、四塩化チタンを生成させるために用いられる。漂白剤およびプールの水の殺菌などに用いられる晒粉は消石灰に塩素ガスを反応させて製造される。
食塩水の電解により水酸化ナトリウムを製造する際、副産物として得られる塩素の使途の開拓が課題となっている。ここで得られる塩化水素は化学薬品合成用、ポリ塩化ビニルの原料などに用いられるが、水酸化ナトリウムの需要のほうが多い。
| 晒粉の製造 |
Ca(OH)2 + Cl2 → Ca(OCl)Cl + H2O |
| 塩化ナトリウム水溶液の電気分解 |
| 陰極 |
2H2O + 2e- → H2 + 2OH- |
| 陽極 |
2Cl- → Cl2 + 2e- |
主な化合物
化合物中の塩素の酸化数には-1, +1, +3, +5, +7などが存在する。
| HCl |
塩化水素 |
Hydrogen Chloride |
| HClO |
次亜塩素酸 |
Hypochlorous Acid |
| HClO2 |
亜塩素酸 |
Chlorous Acid |
| HClO3 |
塩素酸 |
Chloric Acid |
| HClO4 |
過塩素酸 |
Perchloric Acid |
|


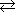 H+ + Cl- + HClO
H+ + Cl- + HClO
