性質および化学反応
ナトリウムNatriumはドイツ語であり、タンザニアにあるソーダの湖、ナトロン湖L.Natronに由来する。英語名Sodiumはソーダに由来する。
銀白色の軟らかい金属元素でプラスチックのへらでも容易に切断することが可能であり、可視光線の反射率は98%程度で銀に匹敵する。
空気中で極めて酸化されやすく過酸化ナトリウムNa2O2を生成し、水と反応して水素ガスを発生し水酸化ナトリウムとなり強いアルカリ性水溶液を生ずる。水との反応では場合により発火し、大豆粒より大きいものは爆発することもある。アルコールとも反応して溶解し、ナトリウムアルコキシドと水素を生成する。このため金属ナトリウムは通常、灯油中またはアルゴンと伴にアンプルに密封して保存する。またナトリウムは液体アンモニアに溶解し、青色の電導性溶液を生ずる。この溶液中にはナトリウムイオンと溶媒和電子が存在し、濃厚溶液ではブロンズ様となり、液体金属に近い状態となる。水銀には激しく発熱して溶解しナトリウムアマルガムを生成する。
ナトリウムを含む物質を炎に入れると黄色の強い炎色反応を示し、そのスペクトル線はD線(589.592 nm, 588.995 nm)と呼ばれ光学測定の基準としてよく用いられる。
| 大気中での酸化 |
2Na + O2 → Na2O2 |
ΔH °= -510.87kJ |
| 水との反応 |
2Na + 2H2O → 2NaOH + H2 |
ΔH °= -368.57kJ |
| エタノールとの反応 |
2Na + 2C2H5OH → 2C2H5ONa + H2 |
ΔH °= -376kJ |
| 液体アンモニアへの溶解 |
Na + am → Na+am + e-am |
 |  |
| ナトリウムの単体 | ナトリウムと水との反応 |
自然界における存在
ナトリウムは活性が強く自然界で単体として存在することはあり得ず、ほとんど全てナトリウムイオンNa+として普遍的に存在する。海水中には塩化物イオンに次いで多量に溶存し、塩の主成分を構成する。花崗岩および玄武岩中では曹長石NaAlSi3O8または斜長石NaXCa1-xAl2-xSi2+xO8として存在している。このため、マントルよりも地殻により多く濃縮されていると考えられる。地下数十kmの高圧条件下では翡翠輝石NaAlSi2O6の安定領域となり得るが、翡翠自体は産出が稀な鉱物で、国内では糸魚川周辺など数ヶ所、海外ではミャンマーが主な産地である。
生体内ではナトリウムイオンはカリウムイオンと伴に筋肉の伸縮運動に関わり、重要なミネラルの一つである、
 |  |
| 翡翠の原石 親不知海岸産 | ソーダライト(青色部分)および曹長石(白色部分) |
 太平洋黒潮の海水
太平洋黒潮の海水
工業的用途
岩塩を原料としてソルベー法により炭酸ナトリウムが合成され、ガラスおよび洗剤などの原料として用いられている。隔膜法による食塩水の電気分解により水酸化ナトリウムが多量に生産され、製紙工業、繊維工業、その他化学工業用に広く用いられている。金属ナトリウムは塩化ナトリウムまたは水酸化ナトリウムの融解電解により製造され、需要は比較的少量であるが、化学薬品製造用などに用いられる。
石英ガラスに封入したナトリウム蒸気中に放電させることにより発光するナトリウムランプはD線による単色光を発するため、物がはっきり見えることからトンネルおよび高速道路などの照明に用いられるが、逆に目が疲れるとの説があり、最近ではより白色を帯びた高圧ナトリウムランプおよびHf白色ランプが多くなっている。
核燃料サイクルの一環として、プルトニウムを多量に生産する高速増殖炉の冷却材として使用する試みがなされていたが、「もんじゅ」のナトリウム漏洩事故以来、金属ナトリウムの危険性がクローズアップされた。
| ソルベー法による炭酸ナトリウムの合成 |
NaClaq + NH3aq + CO2(g) + H2O 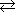 NaHCO3(s)↓ + NH4Claq NaHCO3(s)↓ + NH4Claq |
K = 65 |
| 2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g)(>200℃) |
ΔH °= +135.6kJ |
| ルブラン法による炭酸ナトリウムの合成 |
| 2NaCl + H2SO4 → Na2SO4 + 2HCl |
| Na2SO4 + CaCO3 + 4C → Na2CO3 + CaS + 4CO |
主な化合物
化合物中ではナトリウムは常に1価の陽イオンNa+として存在する。
| NaOH |
水酸化ナトリウム(苛性ソーダ) |
Sodium Hydroxide |
| Na2CO3 |
炭酸ナトリウム(ソーダ灰) |
Sodium Carbonate |
| NaHCO3 |
炭酸水素ナトリウム(重曹) |
Sodium Hydrogen Carbonate |
| NaCl |
塩化ナトリウム |
Sodium Chloride |
| Na2SO4 |
硫酸ナトリウム(芒硝) |
Sodium Sulfate |
| NaNO3 |
硝酸ナトリウム |
Sodium Nitrate |
|






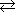 NaHCO3(s)↓ + NH4Claq
NaHCO3(s)↓ + NH4Claq